在加拿大
首例新冠危重症患者全肺活检病理报告:提示肺部病变起源部位新冠肺炎病理目前仍有待深入研究。除华中科技大学刘良等人实施的遗体解剖之外,部分科研团队也在从组织活检渠道获取病理分析。中科院院士、国家感染性疾病临床医学研究中心主任王福生教授率领的团队,武汉大学中南医院肖书渊主任医师团队此前也均发布相关病理发现。当地时间3月2日,深圳市第三人民医院(南方科技大学第二附属医院)、国家感染性疾病临床医学研究中心的研究团队在预印本网站Preprints更新发布了“新型冠状病毒肺炎危重症患者的临床病理分析”(Clinical pathology of critical patient with novel coronavirus pneumonia (COVID-19),最早于2月27日发布第一版),该研究尚未经同行评议。研究团队对1例进行了肺移植手术的危重症新冠肺炎患者的全肺进行了活检,通过HE染色、免疫组织化学染色和特殊染色(包括Masson染色、PAS染色和六胺银染色)对其病理变化进行了描述。全肺组织呈弥漫性充血或部分出血坏死。右肺右叶外缘明显可见出血性坏死。肺切面有严重的充血和出血改变。研究团队称,他们首次描述了新冠肺炎危重症患者的主要病理变化。该研究展示了危重症患者的临床病理活检,这可能为深入了解该病的发病机制和严重程度提供了依据。该论文通讯作者之一为深圳市第三人民医院院长兼党委书记、主任医师刘磊教授。据医院官网介绍,国家感染性疾病临床医学研究中心、深圳市第三人民医院是深圳唯一收治新冠肺炎确诊患者的定点医院,也是除湖北省外,单中心收治新冠肺炎患者最多的医院。此外,医院拥有占地面积391平方米的P3实验室,具有开展新冠病毒肺炎系列研究的临床资源和研究综合条件。截至目前,关于流行病学和临床特征的研究已不断累积。多数患者出现发热、咳嗽等症状,但小部分患者出现急性呼吸衰竭、急性呼吸窘迫综合征(ARDS)、感染性休克等严重并发症。值得注意的是,目前来看,新冠肺炎的危重症患者预后差,死亡率高。研究中这例患者66岁,2020年1月4日从武汉返回深圳,并出现高热和咳嗽症状。除8年高血压病史外,无其他基础疾病,心功能良好。胸部X线检查可见左右肺亮度增高、多发阴影。 该例患者被诊断为新冠肺炎(危重型)和严重ARDS,并发呼吸衰竭,行肺移植手术。研究团队在P3实验室对肺病理组织进行了固定、脱水、石蜡包埋、组织切片、特殊组织化学染色等。
 右肺(A、B)、左肺(C、D)大体形态,右肺边缘明显出血坏死。结果显示, 该病例全肺表面呈古铜色,肉眼可见弥漫性充血,多为点状出血,部分出血坏死。值得注意的是,出血坏死主要发生在肺右下叶、中叶和上叶的外边缘。支气管被粘液和出血渗出物覆盖。肺切面有严重的充血和出血改变。组织病理学表现为大量的肺间质纤维化伴部分透明变性,肺出血性梗死。小血管增生,血管壁增厚,管腔狭窄闭塞。炎症细胞间质浸润,包括淋巴细胞、浆细胞和单核细胞。经Masson染色证实肺间质纤维化。未见其他细菌、真菌感染。
右肺(A、B)、左肺(C、D)大体形态,右肺边缘明显出血坏死。结果显示, 该病例全肺表面呈古铜色,肉眼可见弥漫性充血,多为点状出血,部分出血坏死。值得注意的是,出血坏死主要发生在肺右下叶、中叶和上叶的外边缘。支气管被粘液和出血渗出物覆盖。肺切面有严重的充血和出血改变。组织病理学表现为大量的肺间质纤维化伴部分透明变性,肺出血性梗死。小血管增生,血管壁增厚,管腔狭窄闭塞。炎症细胞间质浸润,包括淋巴细胞、浆细胞和单核细胞。经Masson染色证实肺间质纤维化。未见其他细菌、真菌感染。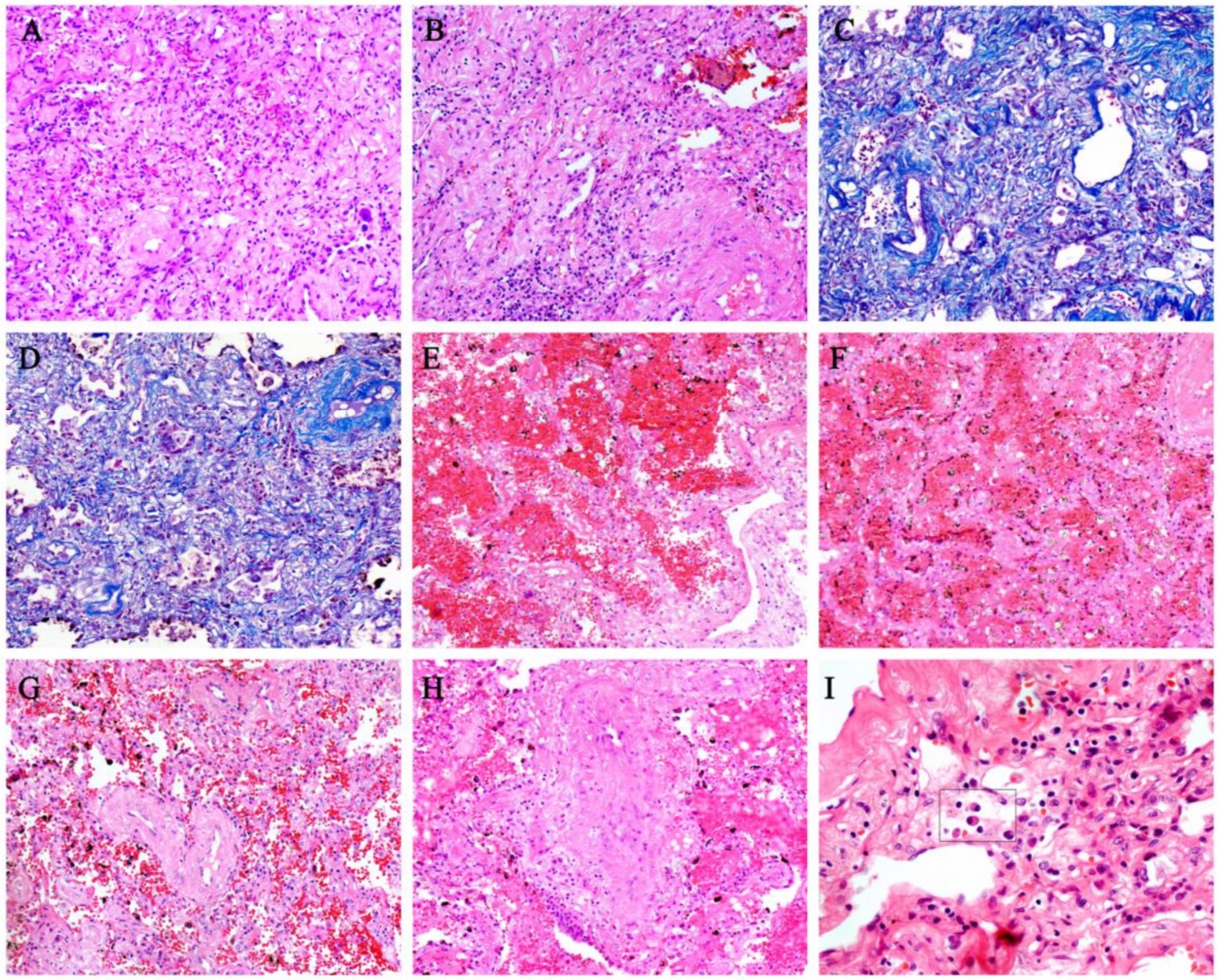 危重病人肺间质组织病理活检:A、大量肺间质纤维化。B、肺间质纤维化伴部分透明变性。C、Masson染色肺间质纤维化。D、Masson染色间质纤维化,肺泡上皮细胞脱屑。E、肺出血改变。F、肺出血性梗死。G、血管壁增厚,管腔狭窄。H、闭塞性脉管炎由炎性细胞包围。I、间质浆细胞浸润(方框示意)。可见肺泡炎伴肺泡上皮细胞(主要为II型)的萎缩、增殖、脱屑及鳞状上皮化生的各种改变。其余肺泡显示肺泡隔增厚,肺泡上皮细胞坏死、脱屑。此外,还观察到大量纤维素样渗出物、多核巨细胞和胞浆内病毒包涵体。坏死性细支气管炎表现为细支气管壁坏死,管腔内可见上皮细胞。
危重病人肺间质组织病理活检:A、大量肺间质纤维化。B、肺间质纤维化伴部分透明变性。C、Masson染色肺间质纤维化。D、Masson染色间质纤维化,肺泡上皮细胞脱屑。E、肺出血改变。F、肺出血性梗死。G、血管壁增厚,管腔狭窄。H、闭塞性脉管炎由炎性细胞包围。I、间质浆细胞浸润(方框示意)。可见肺泡炎伴肺泡上皮细胞(主要为II型)的萎缩、增殖、脱屑及鳞状上皮化生的各种改变。其余肺泡显示肺泡隔增厚,肺泡上皮细胞坏死、脱屑。此外,还观察到大量纤维素样渗出物、多核巨细胞和胞浆内病毒包涵体。坏死性细支气管炎表现为细支气管壁坏死,管腔内可见上皮细胞。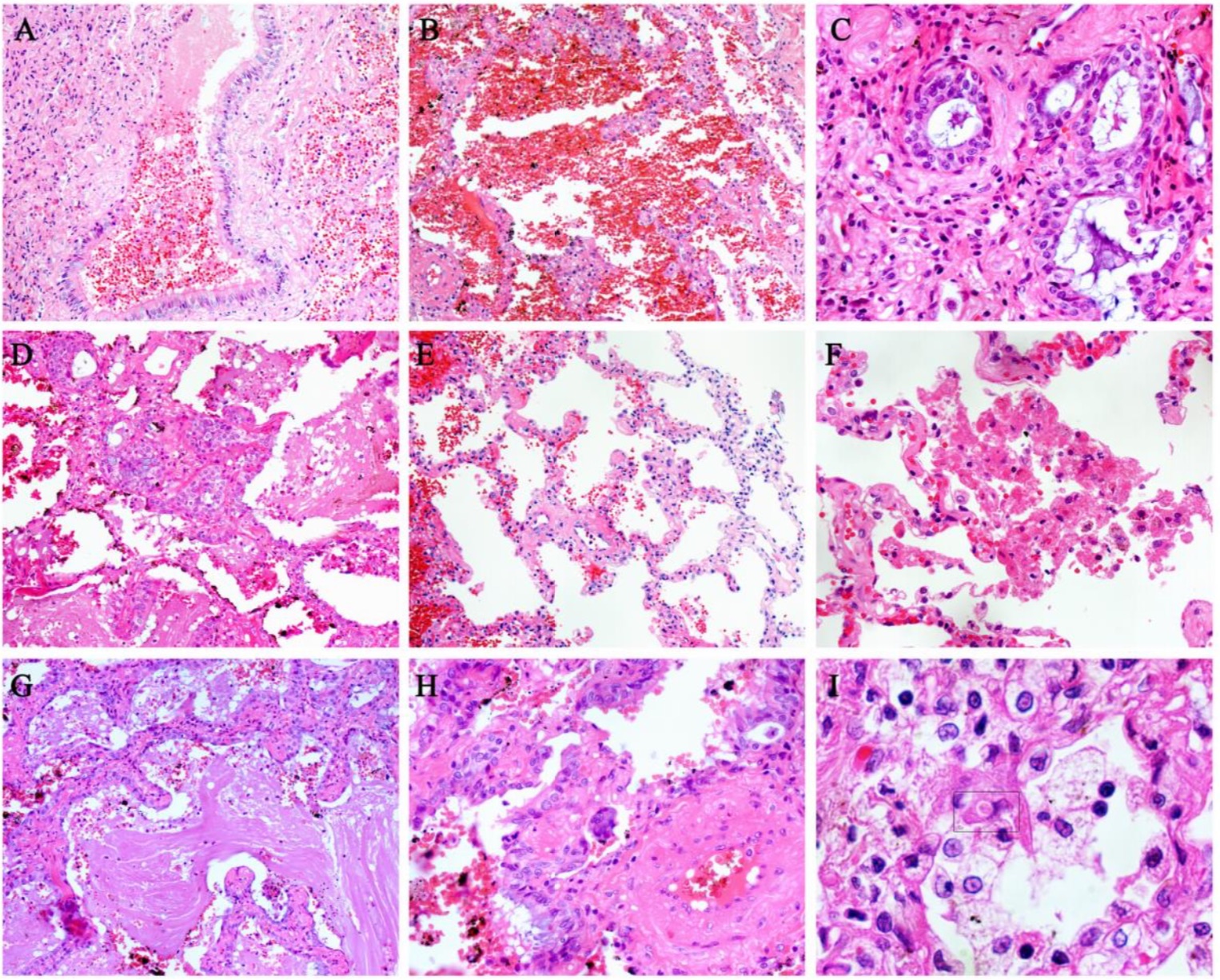 COVID-19肺泡改变活检。A、坏死性细支气管炎,腔内可见坏死的支气管上皮细胞。B、肺泡上皮细胞萎缩。C、细支气管上皮细胞鳞状上皮化生。D、肺泡细胞鳞状上皮化生。E、肺泡隔增厚。F、肺泡上皮细胞坏死、脱屑。G、腔内有炎性细胞和大量纤维素样渗出物。H、多核巨细胞。I、肺泡上皮细胞胞浆内病毒包涵体(方框示意)。免疫组织学结果显示,CD3、CD4、CD8、CD20、CD79a、CD5和CD38等免疫细胞呈阳性。研究发现免疫细胞的阳性表达主要集中在肺间质和血管附近。此外,CD31、TTF1、CK5/6、CK7、CK19、SMA、F VIII和IV型胶原也呈阳性(部分数据未显示)。
COVID-19肺泡改变活检。A、坏死性细支气管炎,腔内可见坏死的支气管上皮细胞。B、肺泡上皮细胞萎缩。C、细支气管上皮细胞鳞状上皮化生。D、肺泡细胞鳞状上皮化生。E、肺泡隔增厚。F、肺泡上皮细胞坏死、脱屑。G、腔内有炎性细胞和大量纤维素样渗出物。H、多核巨细胞。I、肺泡上皮细胞胞浆内病毒包涵体(方框示意)。免疫组织学结果显示,CD3、CD4、CD8、CD20、CD79a、CD5和CD38等免疫细胞呈阳性。研究发现免疫细胞的阳性表达主要集中在肺间质和血管附近。此外,CD31、TTF1、CK5/6、CK7、CK19、SMA、F VIII和IV型胶原也呈阳性(部分数据未显示)。 危重症COVID-19免疫组织学结果。连续组织切片显示CD3 (A)、CD4 (B)、CD8 (C)、CD20 (D)、CD79a (E)、CD5 (F)、CD38 (G)、CK7 (H)、IV型胶原(I)阳性表达。研究团队在讨论环节指出,在SARS的肺病理学方面,此前有课题组发现了局部出血坏死、肺泡炎和支气管炎、肺泡上皮细胞脱屑等肺部病变。 实际上,在这项研究中,结果也显示了肺泡水肿伴出血、细支气管炎、肺泡炎伴上皮细胞炎性损伤等肺部损害。值得注意的是,在显微镜下研究团队观察到大量的肺间质纤维化、管壁增厚、管腔狭窄和闭塞发生较多。研究团队推测,这些主要的改变可能导致危重病人出现严重的呼吸衰竭。另一方面,目前大体观察发现出血性坏死主要存在于右肺外缘。这一观察提示以下两点:第一,这可能是重症患者死亡的主要原因之一;第二,COVID-19的主要病变可能首先起源于此。另外,最近的研究也表明,新冠病毒与SARS-CoV具有相同的细胞进入受体,即ACE2(血管紧张素转化酶II)。一般情况下,ACE2蛋白在肺泡细胞、支气管上皮和血管内皮细胞中表达,因此与SARS-CoV-2感染结合ACE2会导致急性肺损伤和肺水肿。研究团队此次也观察到大量肺水肿和出血,脱落支气管和肺泡上皮细胞。另一方面,细胞因子风暴与过度免疫反应和不受控制的促炎反应有关,后者则会导致严重的器官疾病,包括肺损伤。目前几个代表性的细胞因子已确定,包括IL-1β、IL-18、TNF-α、IL-6、IL-8和IL-10,这些均由包括CD8和CD4的各种免疫细胞产生和调节。值得一提的是,研究团队观察到淋巴细胞、单核细胞和浆细胞浸润肺间质,这些类型的炎症细胞都经免疫组织学方法证实。而如前所述,肺间质大量纤维化、管腔狭窄等病理改变发生在该病例的肺部,研究团队认为,这些结果可以解释为什么危重病人有急性肺功能障碍
危重症COVID-19免疫组织学结果。连续组织切片显示CD3 (A)、CD4 (B)、CD8 (C)、CD20 (D)、CD79a (E)、CD5 (F)、CD38 (G)、CK7 (H)、IV型胶原(I)阳性表达。研究团队在讨论环节指出,在SARS的肺病理学方面,此前有课题组发现了局部出血坏死、肺泡炎和支气管炎、肺泡上皮细胞脱屑等肺部病变。 实际上,在这项研究中,结果也显示了肺泡水肿伴出血、细支气管炎、肺泡炎伴上皮细胞炎性损伤等肺部损害。值得注意的是,在显微镜下研究团队观察到大量的肺间质纤维化、管壁增厚、管腔狭窄和闭塞发生较多。研究团队推测,这些主要的改变可能导致危重病人出现严重的呼吸衰竭。另一方面,目前大体观察发现出血性坏死主要存在于右肺外缘。这一观察提示以下两点:第一,这可能是重症患者死亡的主要原因之一;第二,COVID-19的主要病变可能首先起源于此。另外,最近的研究也表明,新冠病毒与SARS-CoV具有相同的细胞进入受体,即ACE2(血管紧张素转化酶II)。一般情况下,ACE2蛋白在肺泡细胞、支气管上皮和血管内皮细胞中表达,因此与SARS-CoV-2感染结合ACE2会导致急性肺损伤和肺水肿。研究团队此次也观察到大量肺水肿和出血,脱落支气管和肺泡上皮细胞。另一方面,细胞因子风暴与过度免疫反应和不受控制的促炎反应有关,后者则会导致严重的器官疾病,包括肺损伤。目前几个代表性的细胞因子已确定,包括IL-1β、IL-18、TNF-α、IL-6、IL-8和IL-10,这些均由包括CD8和CD4的各种免疫细胞产生和调节。值得一提的是,研究团队观察到淋巴细胞、单核细胞和浆细胞浸润肺间质,这些类型的炎症细胞都经免疫组织学方法证实。而如前所述,肺间质大量纤维化、管腔狭窄等病理改变发生在该病例的肺部,研究团队认为,这些结果可以解释为什么危重病人有急性肺功能障碍评论
金角大王 说:首例新冠危重症患者全肺活检病理报告:提示肺部病变起源部位新冠肺炎病理目前仍有待深入研究。除华中科技大学刘良等人实施的遗体解剖之外,部分科研团队也在从组织活检渠道获取病理分析。中科院院士、国家感染性疾病临床医学研究中心主任王福生教授率领的团队,武汉大学中南医院肖书渊主任医师团队此前也均发布相关病理发现。当地时间3月2日,深圳市第三人民医院(南方科技大学第二附属医院)、国家感染性疾病临床医学研究中心的研究团队在预印本网站Preprints更新发布了“新型冠状病毒肺炎危重症患者的临床病理分析”(Clinical pathology of critical patient with novel coronavirus pneumonia (COVID-19),最早于2月27日发布第一版),该研究尚未经同行评议。研究团队对1例进行了肺移植手术的危重症新冠肺炎患者的全肺进行了活检,通过HE染色、免疫组织化学染色和特殊染色(包括Masson染色、PAS染色和六胺银染色)对其病理变化进行了描述。全肺组织呈弥漫性充血或部分出血坏死。右肺右叶外缘明显可见出血性坏死。肺切面有严重的充血和出血改变。研究团队称,他们首次描述了新冠肺炎危重症患者的主要病理变化。该研究展示了危重症患者的临床病理活检,这可能为深入了解该病的发病机制和严重程度提供了依据。该论文通讯作者之一为深圳市第三人民医院院长兼党委书记、主任医师刘磊教授。据医院官网介绍,国家感染性疾病临床医学研究中心、深圳市第三人民医院是深圳唯一收治新冠肺炎确诊患者的定点医院,也是除湖北省外,单中心收治新冠肺炎患者最多的医院。此外,医院拥有占地面积391平方米的P3实验室,具有开展新冠病毒肺炎系列研究的临床资源和研究综合条件。截至目前,关于流行病学和临床特征的研究已不断累积。多数患者出现发热、咳嗽等症状,但小部分患者出现急性呼吸衰竭、急性呼吸窘迫综合征(ARDS)、感染性休克等严重并发症。值得注意的是,目前来看,新冠肺炎的危重症患者预后差,死亡率高。研究中这例患者66岁,2020年1月4日从武汉返回深圳,并出现高热和咳嗽症状。除8年高血压病史外,无其他基础疾病,心功能良好。胸部X线检查可见左右肺亮度增高、多发阴影。 该例患者被诊断为新冠肺炎(危重型)和严重ARDS,并发呼吸衰竭,行肺移植手术。研究团队在P3实验室对肺病理组织进行了固定、脱水、石蜡包埋、组织切片、特殊组织化学染色等。右肺(A、B)、左肺(C、D)大体形态,右肺边缘明显出血坏死。结果显示, 该病例全肺表面呈古铜色,肉眼可见弥漫性充血,多为点状出血,部分出血坏死。值得注意的是,出血坏死主要发生在肺右下叶、中叶和上叶的外边缘。支气管被粘液和出血渗出物覆盖。肺切面有严重的充血和出血改变。组织病理学表现为大量的肺间质纤维化伴部分透明变性,肺出血性梗死。小血管增生,血管壁增厚,管腔狭窄闭塞。炎症细胞间质浸润,包括淋巴细胞、浆细胞和单核细胞。经Masson染色证实肺间质纤维化。未见其他细菌、真菌感染。危重病人肺间质组织病理活检:A、大量肺间质纤维化。B、肺间质纤维化伴部分透明变性。C、Masson染色肺间质纤维化。D、Masson染色间质纤维化,肺泡上皮细胞脱屑。E、肺出血改变。F、肺出血性梗死。G、血管壁增厚,管腔狭窄。H、闭塞性脉管炎由炎性细胞包围。I、间质浆细胞浸润(方框示意)。可见肺泡炎伴肺泡上皮细胞(主要为II型)的萎缩、增殖、脱屑及鳞状上皮化生的各种改变。其余肺泡显示肺泡隔增厚,肺泡上皮细胞坏死、脱屑。此外,还观察到大量纤维素样渗出物、多核巨细胞和胞浆内病毒包涵体。坏死性细支气管炎表现为细支气管壁坏死,管腔内可见上皮细胞。COVID-19肺泡改变活检。A、坏死性细支气管炎,腔内可见坏死的支气管上皮细胞。B、肺泡上皮细胞萎缩。C、细支气管上皮细胞鳞状上皮化生。D、肺泡细胞鳞状上皮化生。E、肺泡隔增厚。F、肺泡上皮细胞坏死、脱屑。G、腔内有炎性细胞和大量纤维素样渗出物。H、多核巨细胞。I、肺泡上皮细胞胞浆内病毒包涵体(方框示意)。免疫组织学结果显示,CD3、CD4、CD8、CD20、CD79a、CD5和CD38等免疫细胞呈阳性。研究发现免疫细胞的阳性表达主要集中在肺间质和血管附近。此外,CD31、TTF1、CK5/6、CK7、CK19、SMA、F VIII和IV型胶原也呈阳性(部分数据未显示)。危重症COVID-19免疫组织学结果。连续组织切片显示CD3 (A)、CD4 (B)、CD8 (C)、CD20 (D)、CD79a (E)、CD5 (F)、CD38 (G)、CK7 (H)、IV型胶原(I)阳性表达。研究团队在讨论环节指出,在SARS的肺病理学方面,此前有课题组发现了局部出血坏死、肺泡炎和支气管炎、肺泡上皮细胞脱屑等肺部病变。 实际上,在这项研究中,结果也显示了肺泡水肿伴出血、细支气管炎、肺泡炎伴上皮细胞炎性损伤等肺部损害。值得注意的是,在显微镜下研究团队观察到大量的肺间质纤维化、管壁增厚、管腔狭窄和闭塞发生较多。研究团队推测,这些主要的改变可能导致危重病人出现严重的呼吸衰竭。另一方面,目前大体观察发现出血性坏死主要存在于右肺外缘。这一观察提示以下两点:第一,这可能是重症患者死亡的主要原因之一;第二,COVID-19的主要病变可能首先起源于此。另外,最近的研究也表明,新冠病毒与SARS-CoV具有相同的细胞进入受体,即ACE2(血管紧张素转化酶II)。一般情况下,ACE2蛋白在肺泡细胞、支气管上皮和血管内皮细胞中表达,因此与SARS-CoV-2感染结合ACE2会导致急性肺损伤和肺水肿。研究团队此次也观察到大量肺水肿和出血,脱落支气管和肺泡上皮细胞。另一方面,细胞因子风暴与过度免疫反应和不受控制的促炎反应有关,后者则会导致严重的器官疾病,包括肺损伤。目前几个代表性的细胞因子已确定,包括IL-1β、IL-18、TNF-α、IL-6、IL-8和IL-10,这些均由包括CD8和CD4的各种免疫细胞产生和调节。值得一提的是,研究团队观察到淋巴细胞、单核细胞和浆细胞浸润肺间质,这些类型的炎症细胞都经免疫组织学方法证实。而如前所述,肺间质大量纤维化、管腔狭窄等病理改变发生在该病例的肺部,研究团队认为,这些结果可以解释为什么危重病人有急性肺功能障碍点击展开...好贴。虽然太复杂
评论
“I believe that Alberta is not just a place on the map.This Alberta is a place where we judge people not on the basis of where they were born, how they pray or who they love, but on how hard they work, and how well they treat others.”--Jason Kennedy 好贴。虽然太复杂点击展开...
评论
金角大王 说:这贴比较涉及专业知识点击展开...这已经专业得不能再专业了。